Природа межмолекулярных взаимодействии
Дипольный момент молекул. Для уяснения сил взаимного притяжения молекул газа необходимо обратиться к рассмотрению закономерностей взаимодействия диполей.
По современным представлениям каждый атом состоит из положительно заряженного ядра, окруженного облаком из отрицательно заряженных электронов, содержащихся в таком количестве, что при любой величине заряда ядра вся система атома является нейтральной. В нормальном состоянии центр тяжести суммарного отрицательного заряда электронов совпадает с центром тяжести положительного заряда ядра. Однако под влиянием некоторого электрического поля центры тяжестей электрических зарядов электронов и ядра в атоме могут сместиться относительно друг друга. В результате в одной части атома будут преобладать положительные заряды, а в другой — отрицательные. При этом между обоими центрами тяжести образуется определенное расстояние.
Инертные газы всегда находятся в атомарном состоянии. Атомы этих газов обладают высокой электрической симметрией, и поэтому у них отсутствует дипольный момент.
Прочные межатомные связи в молекулах образуются за счет частичного перекрывания электронных облаков. Наглядное изображение некоторых молекул представлено на рис. 1-4, где сферические поверхности являются границей электронных облаков [1-5].
В зависимости от расположения атомов в молекуле одни молекулы могут быть электрически нейтральными, а у других молекул наблюдается несовпадение центров тяжести положительных и отрицательных зарядов. Эти молекулы обладают постоянным дипольным моментом и называются полярными.
Когда диполи каждой из взаимодействующих пар атомов противоположны по знаку, они компенсируют друг друга и молекула не имеет полярности. Двухатомные молекулы Н2, N2, Ог и др., состоящие из одинаковых атомов в соответствии с симметричным положением связывающей их электронной пары, не обладают полярностью, и их дипольный момент равен нулю.
Когда же взаимной компенсации диполей взаимодействующих пар атомов не происходит, молекула оказывается полярной.
Двухатомные молекулы, состоящие из неодинаковых атомов, в большинстве случаев полярны. В многоатомных молекулах полярность определяется полярностью отдельных связей и их расположением в молекуле.
Так, в молекуле СОг две двойные связи углеродного атома располагаются на одной прямой и расстояния обоих атомов от углеродного равны между собой, т. е. эти молекулы обладают симметричным строением. Поэтому, хотя каждая из связей С = О обладает некоторой полярностью, вследствие полной взаимной компенсации дипольных моментов связей молекула в целом будет неполярна. Компенсация дипольных моментов связей широко распространена среди углеводородов [1-6].
При несимметричном строении молекулы полной компенсации моментов отдельных связей не происходит. Для вакуумной техники особый интерес представляют пары воды, так как они в основном определяют остаточную атмосферу в непрогреваемых системах. Молекула Н2О построена нелинейно, в ней водородные атомы расположены не симметрично относительно кислородного атома. Вследствие этого связь Н—О полярна, а молекула Н2О в целом обладает значительным дипольным моментом.
При конденсации на поверхности криопанели полярные молекулы в противоположность неполярным молекулам располагаются ориентированно, а прочность их связи оказывается во много раз большей по сравнению с прочностью связей при криоконденсации неполярных молекул.
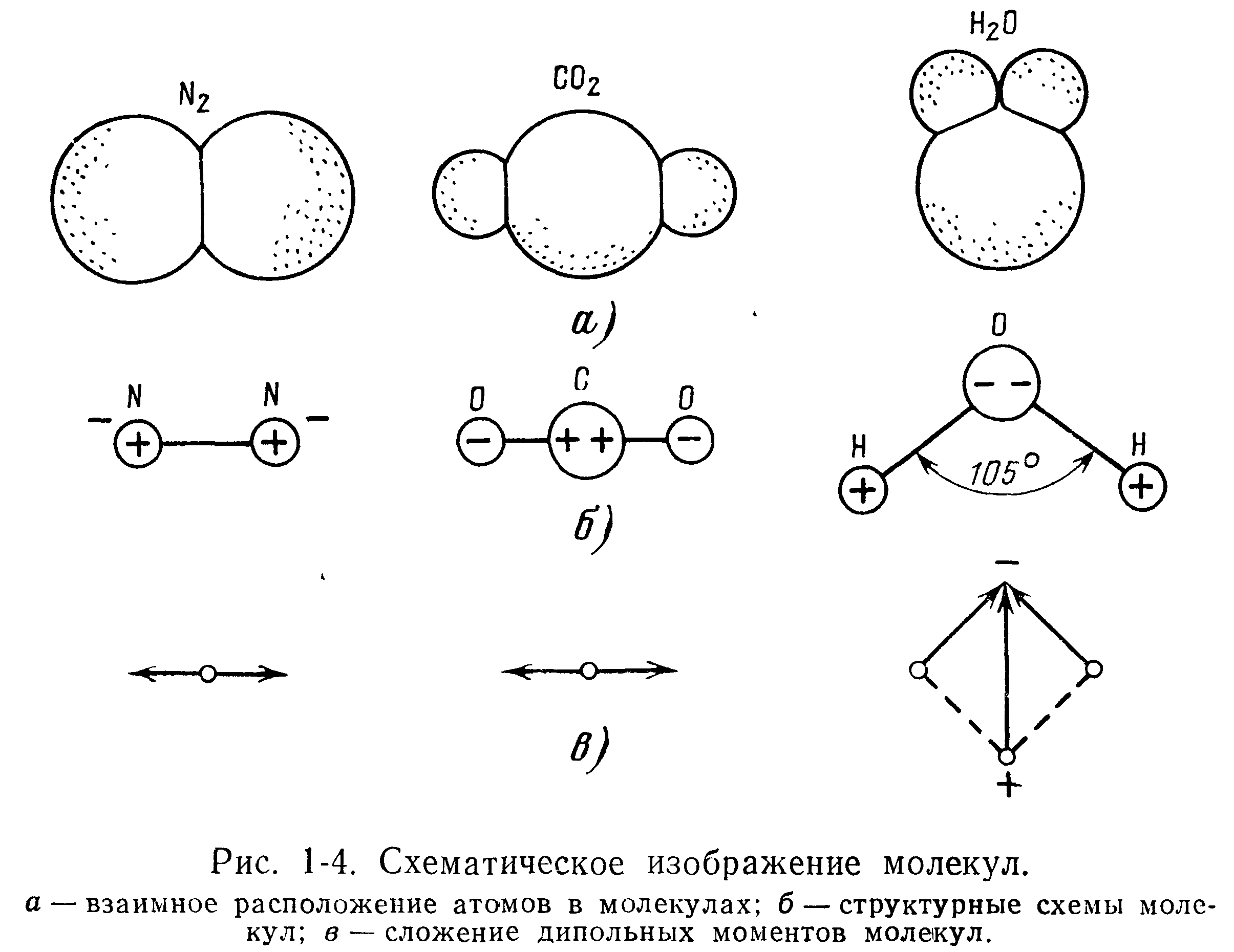
Физическая сущность межмолекулярных взаимодействий. Взаимное притяжение молекул происходит за счет действия сил Ван-дер-Ваальса. Эти силы обусловливают сцепление молекул во многих физических явлениях (отвердевание, ожижение, адсорбция, трение, поверхностное натяжение, вязкость и др.), в том числе и при образовании криоосадка в процессе криоконденсационной огкачки. Взаимное притяжение молекул в упрощенном виде можно представить, если рассматривать молекулы как электрические диполи.
По природе образования диполей различают следующие три типа сил притяжения: ориентационные (Кизома), индукционные (Дебая) и дисперсионные (Лондона) [1-7]. Эти силы во многих случаях при взаимном притяжении молекул действуют одновременно, причем значение каждой из сил различно для разных молекул. Рассмотрим подробнее характер сил межмолекулярного взаимодействия
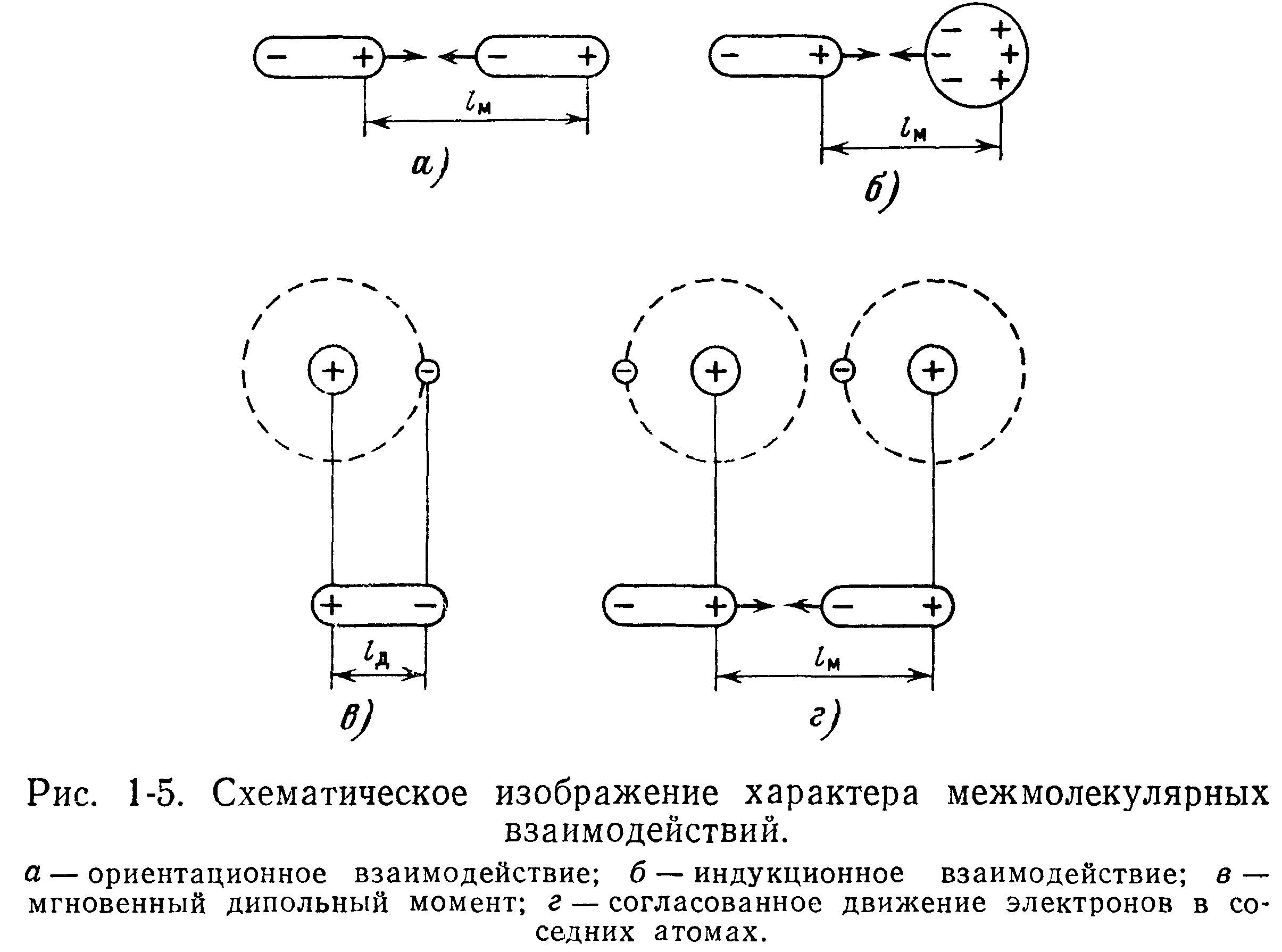
Ориентационные силы преобладают между полярными молекулами с постоянным дипольным моментом (например, Н2О, СО и др.). Силы электростатического взаимодействия диполей стремятся расположить молекулы в определенном порядке. Взаимодействие полярных молекул схематически представлено на рис. 1-5,а, на котором стрелки показывают направляемые притяжения. Работа сил притяжения равна произведению этих сил на расстояние.
Потенциальная энергия Ео, соответствующая силам ориентационного взаимодействия двух изолированных диполей |ii и Ц2, находящихся на расстоянии между ними /м,
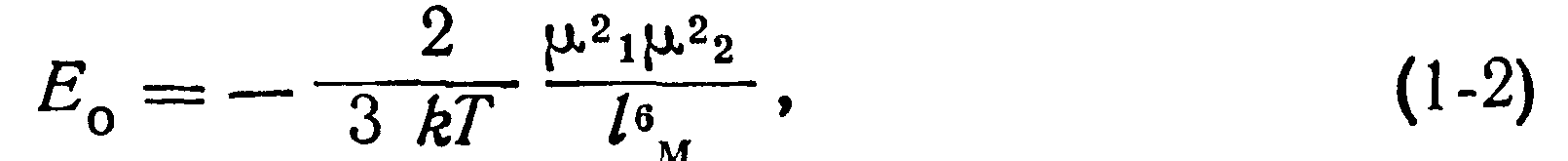
где k — постоянная Больцмана.
Знак минус выражает взаимное притяжение Тепловое движение молекул стремится нарушить упорядоченное расположение взаимодействующих молекул, поэтому энергия ориентационного взаимодействия уменьшается с повышением температуры, что видно из выражения (1-2).
Индукционные взаимодействия объясняются тем, что симметричные молекулы большинства веществ могут сравнительно легко поляризоваться под действием соседних полярных молекул в момент сближения с ними (рис 1-5,6). Возникает наведенный (индуцированный) электрический момент («диполь зеркального отображения») Это приводит к взаимному притяжению молекул подобно взаимодействию постоянных диполей, но более слабому Потенциальная энергия индукционного взаимодействия Би не зависит от температуры и определяется поляризованностью щ неполярной молекулы и дипольным моментом Цг полярной молекулы:
Постоянная а, именуемая поляризованностью, физически представляет собой меру деформируемости или сдвига электронных оболочек молекул в электрическом поле. Эта величина измеряется в кубических сантиметрах и имеет различные значения для различных атомов и молекул. Поляризованность определяется энергией связи электронов с ядром, т. е соответствующей величиной потенциала ионизации Чем ниже потенциал ионизации частицы, тем легче деформируется электронная оболочка.
Межмолекулярное взаимодействие, существующее между неполярными молекулами, невозможно объяснить наличием рассмотренных взаимодействий Так, например, невозможно объяснить сгущение в жидкость инертных газов, молекулы которых обладают высокой электрической симметрией и в статическом состоянии не имеют заметного электрического момента. Поэтому на основе квантовомеханических представлений был введен еще один гид взаимодействий, так называемое дисперсионное взаимодействие. Схематически его можно представить следующим образом. При движении электронов вокруг ядра происходит мгновенное нарушение симметрии, т. е положение электронов в атомах в каждый данный момент не соответствует строго сферически симметричному распределению заряда вокруг ядра. Это обстоятельство приводит к возникновению некоторого мгновенного дипольного момента с длиной, равной радиусу орбиты электрона, как это показано на рис. 1-5,6.
Из-за статистического характера законов, действующих в микромире, всегда в какой-то момент времени найдутся два или несколько атомов с согласованным движением электронов, как показано на рис. 1-5,а, и между ними возникнут силы взаимного притяжения Притягиваясь электростатически, эти атомы оказывают друг на друга еще большее влияние и тем самым понижают свою потенциальную энергию.
Результирующим эффектом такого процесса является тенденция к синхронизации движения электронов во всем огромном количестве частиц, что отвечает меньшему запасу энергии системы и вызывает взаимное притяжение частиц друг к другу.
Дисперсионное взаимодействие происходит между одинаковыми или различными, полярными и неполярными молекулами. Приближенное выражение дисперсионной энергии через поляризованность отдельных молекул имеет вид

где /i, h —величины, обусловленные потенциалами ионизации. Чисто они приблизительно равны потенциалам ионизации
Потенциальная энергия межмолекулярного взаимодействия. Полную энергию взаимных притяжений £Пр двух реальных молекул за счет сил Ван-дер-Ваальса можно представить в виде суммы.
Как уже упоминалось, силы притяжения частиц являются не единственными. При тесном сближении молекул силы притяжения уравновешиваются силами отталкивания, которые становятся существенными на некоторых расстояниях между частицами. Энергия отталкивания Еот заполненных электронных оболочек молекул пропорциональна /12м, т. е.
где х0 — некоторая силовая постоянная отталкивания.
Условно принимая, что силе взаимного притяжения соответствует отрицательная потенциальная энергия, силе отталкивания — положительная, можно представить графически потенциальные энергии £Пр и Вот в зависимости от расстояния между молекулами (рис. 1-6). Кривая /, лежащая в положительной области, выражает зависимость потенциальной энергии отталкивания от межмолекулярного расстояния (1-8). Кривая 2 есть функция возрастания энергии притяжения по мере сближения молекул.
Так как показатели степени при /м в выражении (1-6) меньше, чем в (1-8), то соответственно положительная энергия сближающихся молекул возрастает при малых /м быстрее, чем отрицательная энергия притяжения при тех же значениях /м.
Суммарная потенциальная энергия двух молекул
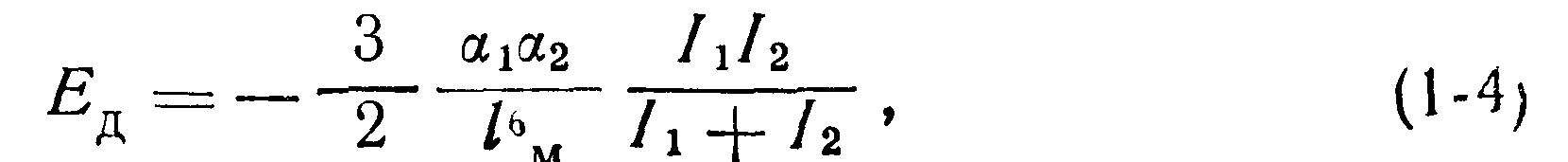

Из соотношений (1-2), (1-3) и (1-4) можно записать
где хп— некоторая силовая постоянная притяжения, которую в общем виде можно записать:

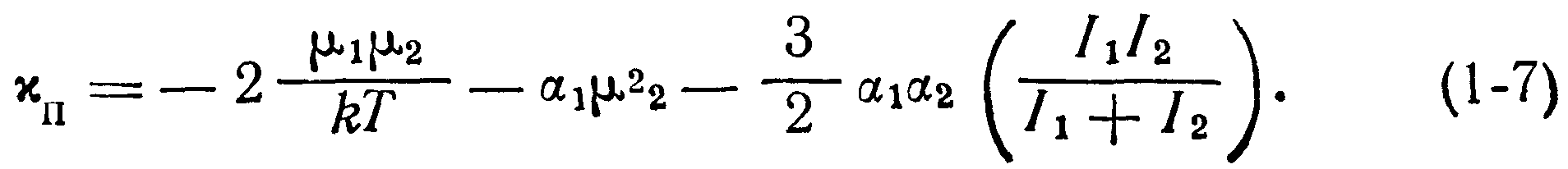

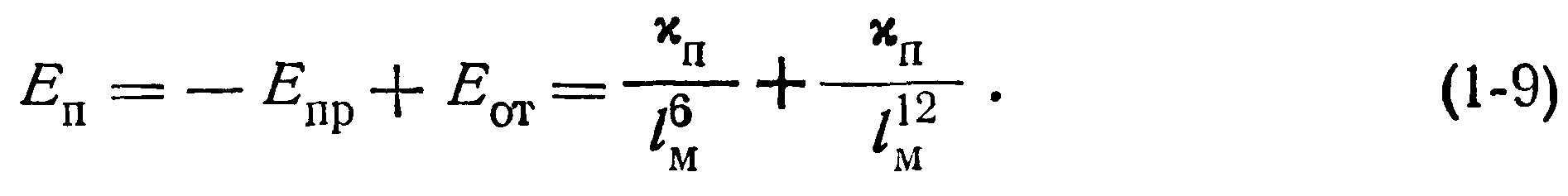
При этом константа притяжения хп определяется из уравнения (1-8), а константа отталкивания х0 может быть найдена методом дифференцирования (при условии равновесия между силами отталкивания и притяжения). Выражение (1-9) называется потенциальной функцией взаимодействия и отражает конкуренцию сил притяжения и отталкивания в зависимости от расстояния между частицами в молекулярном кристалле. График суммарной потенциальной функции взаимодействия представлен кривой АВС на рис. 1-6,6, который получен алгебраическим сложением функций, изображенных на рис. 1-6,а.
Ниспадающая ветвь СВ этой кривой выражает силу притяжения, а восходящая ветвь ВЛ — силу отталкивания. При расстоянии между молекулами Iq=OD силы притяжения и отталкивания численно равны друг другу, и суммарная сила взаимодействия равна нулю. Это положение равновесия соответствует минимуму потенциальной энергии Ео (глубине потенциальной ямы).
Наличие минимума в отрицательной области энергии свидетельствует о том, что система молекул, находящихся на расстоянии /о друг от друга, более устойчива, чем состояние двух изолированных молекул, на величину Ео. Этот выигрыш, получаемый при сближении молекул, и служит энергетической предпосылкой их объединения
Таблица 1-2
Параметры межмолекулярных взаимодействий
(в условных единицах)
|
Молекула вещества |
Эффективный диаметр молекул в конденсированном состоянии, XI О4 мкм |
Положение равновесия, ХЮ4 мкм |
Дипольный момент,
|
Энергия ориента ционного взаимодействия |
Энерги I индукционного взаимодействия |
Энергия диснер сионного взаимо действия |
|
Н2 |
4,19 |
4,07 |
0 |
0 |
0 |
11,3 |
|
Аг |
4,15 |
4,05 |
0 |
0 |
0 |
57 |
|
N2 |
3,74 |
4,23 |
0 |
0 |
0 |
62 |
|
сн4 |
4,49 |
4,49 |
0 |
0 |
0 |
117 |
|
со |
— |
4,36 |
2,42 |
0,0034 |
0,057 |
67 |
|
Н2О |
3,48 |
3,48 |
6,07 |
190 |
10 |
47 |
|
о2 |
3,73 |
4,03 |
0 |
0 |
0 |
— |
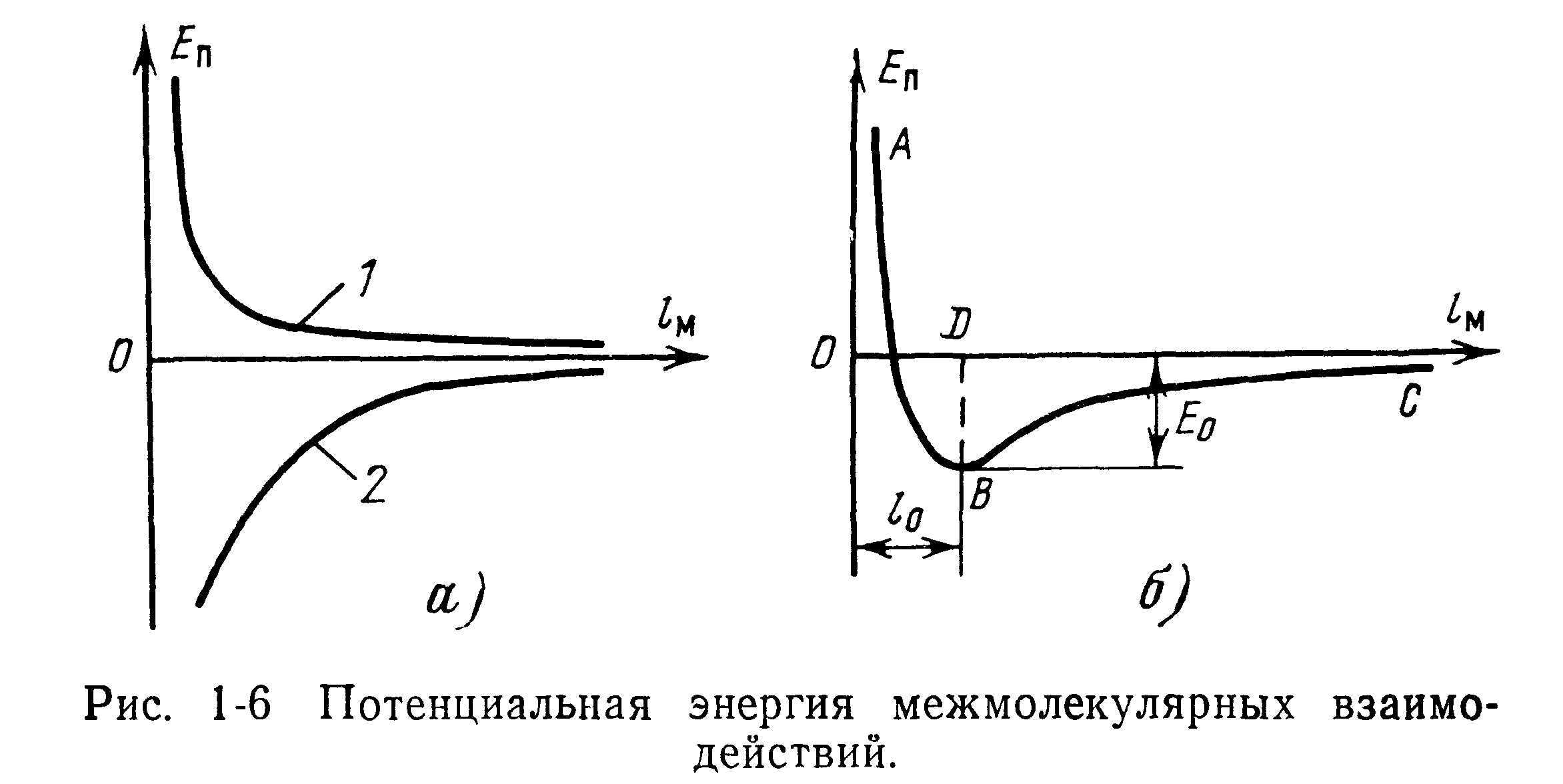
в более крупные частицы, а в конечном итоге причиной образования твердого криоосадка газов на криопанели в процессе криооткачки
Численные значения энергий взаимодействия, а также величина /о для некоторых газов приведены в табл 1-2 [1-5]. Здесь также приведены значения эффективных диаметров молекул и атомов, подсчитанные по плотности их в конденсированном состоянии
Силы Ван-дер-Ваальса, вызывающие конденсацию газов, определяются в основном дисперсионным эффектом (табл 1-2) Только для молекул, обладающих большим дипольным моментом (например, Н2О), энергия ориентационного и индукционного взаимодействия соизмерима с энергией дисперсионного взаимодействия [1-8]
Энергетическая модель взаимодействия газов с криопанелью. Криоосадок представляет собой твердое тело, состоящее из молекул газа, плотно уложенных за счет ван-дер-ваальсовых сил.
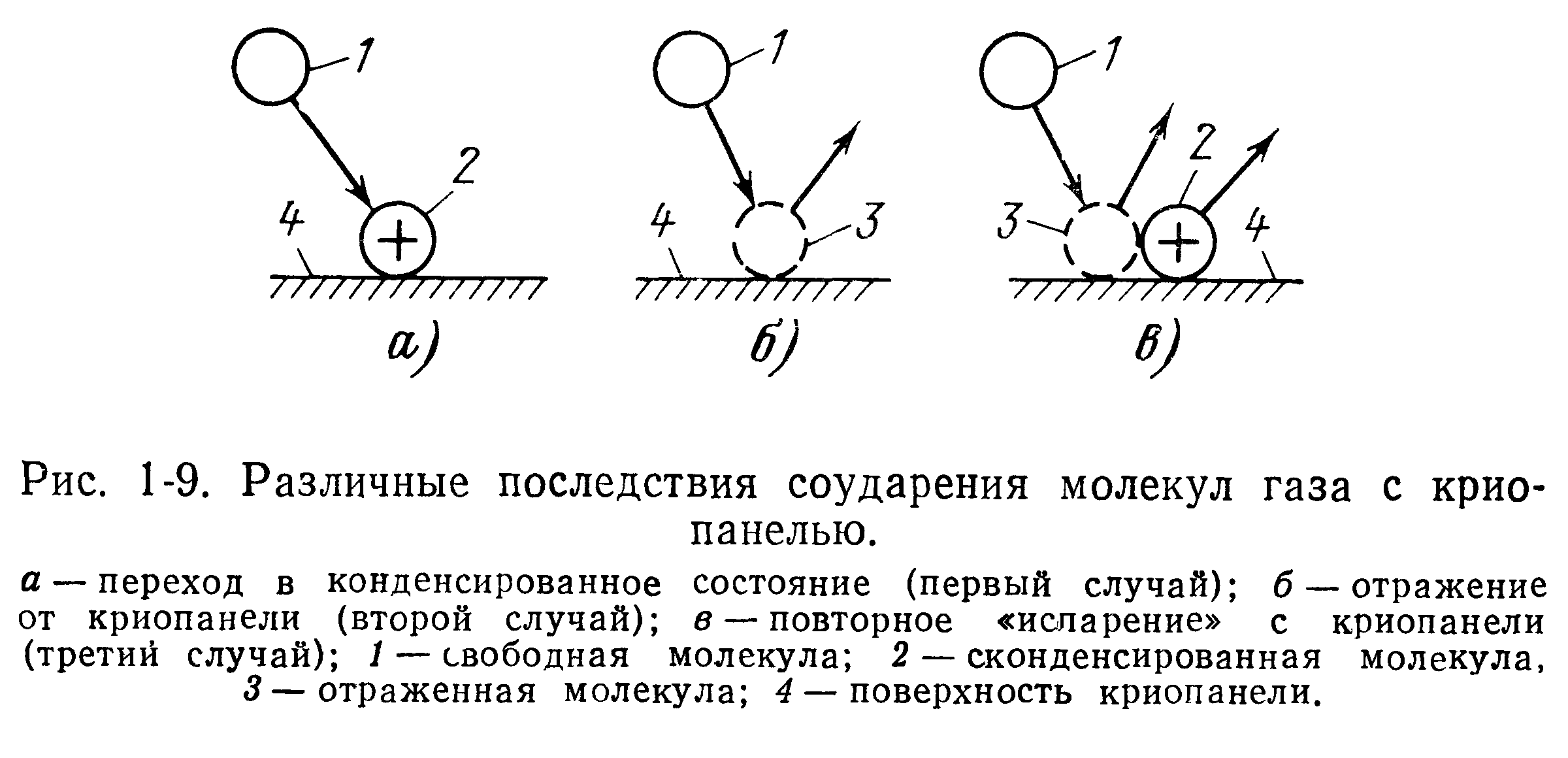
В зависимости от того, обладают или нет полярными свойствами криоосадок и откачиваемые молекулы, могут возникать различные характерные типы взаимодействий во время криоконденсацион-ной откачки, показанные на рис. 1-7.
Рассмотрим процесс взаимодействия молекул откачиваемого газа с охлажденной поверхностью (криопанелью).
Для простоты рассуждений примем, что молекула, находящаяся в составе криоосадка, неподвижна и расположена в начале координат (рис 1-8), а молекула из газовой фазы движется к криопанели вдоль оси абсцисс х (одномерная модель). До сближения с поверхностью криопанели каждая молекула обладает некоторой кинетической энергией EK~kT. Начиная от больших расстояний и до расстояния /0 молекула движется к поверхности криопанели со все возрастающей скоростью под действием сил притяжения, действующих на этом участке. В точку Zo, соответствующую равновесному состоянию, молекула газа придет с некоторым запасом кинетической энергии, равным:


Благодаря этой энергии молекула пройдет через положение равновесия /о и будет приближаться к молекуле, находящейся на поверхности криопанели. В результате взаимодействия часть кинетической энергии £к набегающей на криопанель молекулы будет рассеяна на холодном криоосадке, а оставшаяся часть перейдет в потенциальную Затем молекула под действием сил отталкивания будет удаляться от поверхности криопанели и двигаться с ускорением к центру /о потенциальной ямы, при этом потенциальная энергия будет снова превращаться в кинетическую Ек, которая уже по своему абсолютному значению будет в точке /о меньше Е’к
Общая энергия Е двух частиц во время этих превращений остается постоянной и ее можно разделить на потенциальную Еп (энергию взаимодействия) и кинетическую Ек:
Далее в зависимости от соотношения (глубины потенциальной ямы) Ео и кинетической энергии Ек набегающей молекулы (после взаимодействия с молекулами криоосадка) могу г иметь место следующие три случая.
В состоянии, изображенном на рис 1-8 индексами 1, при малых значениях кинетической энергии E"Ki, т. е. при Ео/Е"к1>1, набегающая молекула под действием сил притяжения может приблизиться на некоторое расстояние Xi и затем начнет удаляться под действием сил отталкивания. В точке х2 она израсходует приобретенную за счет сил отталкивания кинетическую энергию и под действием сил притяжения будет возвращаться к точке /0. В результате молекула не покинет поверхность криопанели и будет совершать колебательные движения между двумя положениями Xi и х2. В этом случае молекулы будут захватываться криопанелью, т. е будет происходить процесс криооткачки. Как видно из рис. 1-8, это состояние характеризуется тем, что

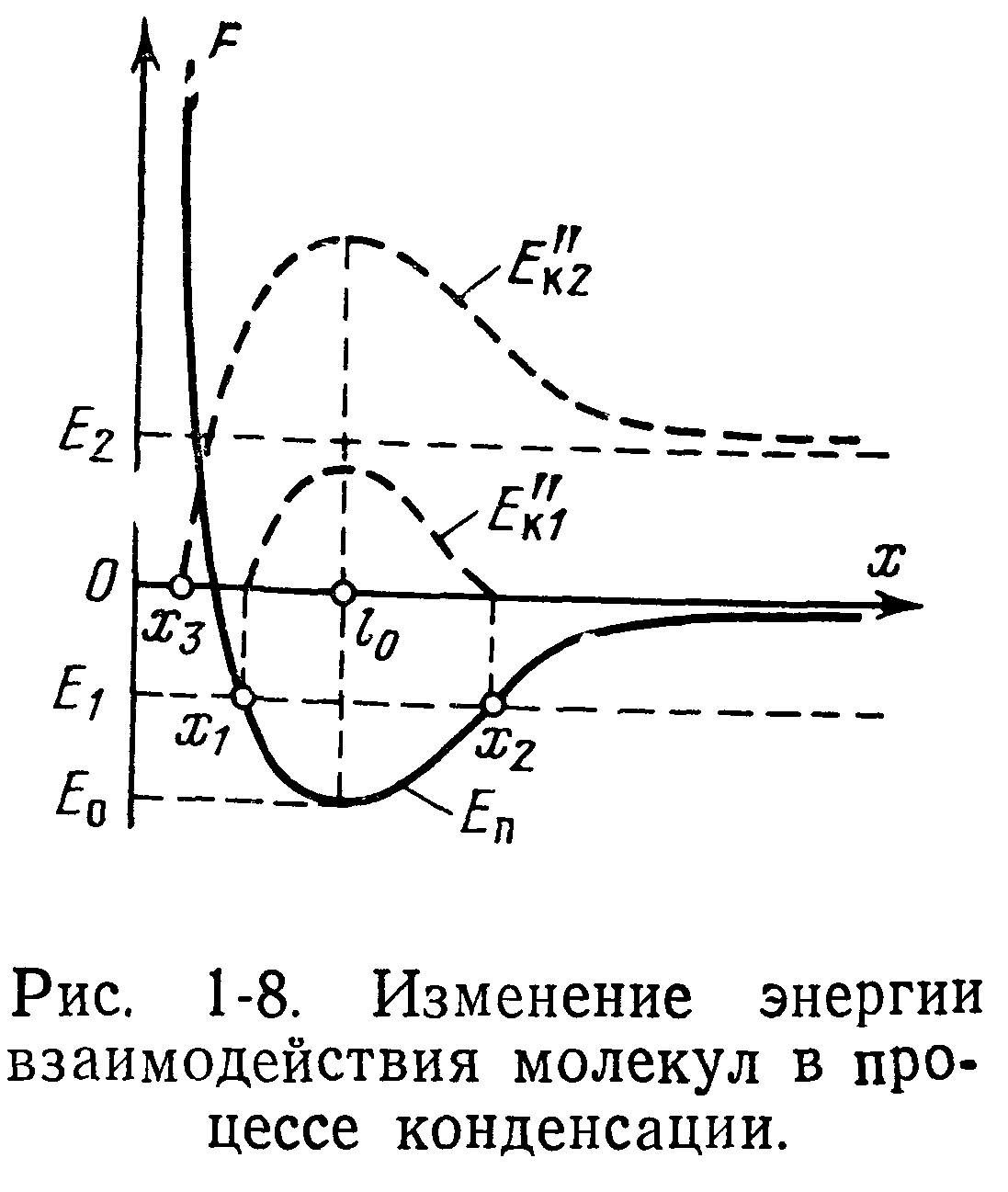


В состоянии, изображенном на рис. 1-8 индексами 2, при больших значениях кинетической энергии £"К2, т. е. при Ео/£"к2<1, набегающая молекула под действием сил притяжения может приблизиться на расстояние х3 (более короткое, чем Xi) и под действием сил отталкивания за счет суммарной положительной энергии £2 покинет поверхность криопанели. Как видно из рис. 1-8, это состояние характеризуется тем, что
Таким образом, если средняя кинетическая энергия Ек падающих на криопанель молекул и молекул, находящихся в криоосадке, не превышает потенциальной энергии взаимодействия их (Ео), то будет осуществляться криокоиденсационная откачка.
Предварительной характеристикой способности различных газов к криоконденсационной откачке может служить критическая температура газа (табл. 1-1). При одинаковой температуре криопанели лучше откачивается газ, имеющий более высокую критическую температуру. Труднее всего откачивается гелий, критическая температура которого ниже, чем у остальных газов.
Условие захвата молекул газа криопанелью можно получить, используя понятие коэффициента аккомодации а, который характеризует интенсивность теплообмена (энергообмена) между взаимодействующими молекулами. Коэффициент аккомодации [1-7] где Ет—тепловая энергия молекул, находящихся в составе криоосадка.



Кроме этих двух крайних случаев, существует промежуточный, когда Ек3 приблизительно равна Ео, т. е.
В этом случае взаимодействие будет очень слабым и первоначально захваченная криопанелью молекула через некоторое время может накопить необходимую энергию от соударяющихся с криопанелью молекул и покинуть криопанель. Различные последствия соударения молекул с криопанелью (криоосадком) наглядно изображены на рис. 1-9.
Зависимость коэффициента аккомодации газов при различных температурах [1-3]
|
Температура, К |
Коэффициент аккомодации |
||
|
Воздух | |
Ht |
Не |
|
|
300 |
0,8—0,9 |
0,3 |
0,3 |
|
77 |
1,0 |
0,5 |
0,6 |
|
20 |
1,0 |
1,0 |
0,6 |
Ориентировочные значения коэффициентов аккомодации для различных температур криопанели приведены в табл. 1-3.
Так как аналитические выражения для определения энергии межмолекулярного взаимодействия очень сложны, то в практике часто пользуются полуимперическими соотношениями, позволяющими производить приближенные инженерные расчеты.


