Представление о структуре и физических свойствах криоосадка
Представление о структуре и физических свойствах криоосадка
Механизм роста криоосадка. Процесс криооткачки сопровождается фазовым переходом из газообразного состояния в твердое. Как показывают физические исследования, твердый криоосадок имеет кристаллическое строение [1-9].
Металлические поверхности криопанели практически никогда не бывают идеально чистыми. Как правило, они покрыты тонкими окисными пленками и имеют на себе по меньшей мере один молекулярный слой адсорбированных газов. Даже чистые поверхности металлов ведут себя подобно полярным адсорбентам [1-6].
В начальной стадии криооткачки на поверхности образуется большое число различно ориентированных зародышей кристаллизации. Для образования зародышей необходимо, чтобы несколько молекул расположились на криопанели в позициях, соответствующих устойчивому кристаллическому строению.
Статистический характер молекулярных процессов приводит к тому, что несколько частиц могут одновременно оказаться рядом на некотором участке криопанели с пониженным энергетическим уровнем. При доста-

Из уравнения (1-15) при выполнении соотношения (1-12) может быть получено условие захвата мотекул газа щиопанелью: точно низкой температуре криопанели их взаимное притяжение окажется сильнее энергии теплового движения, пропорциональной kT. Таким образом, эти частицы оказываются центрами кристаллизации и к ним начинают присоединяться все новые частицы, объединяясь в зародыш кристалла. Последовательные стадии роста криоосадка показаны на рис. 1-10.
В начальный период на криопанели возникает множество центров кристаллизации, вокруг которых происходит рост кристаллов. Эта стадия роста криоосадка схематически показана на рис. 1-10,а, где зародыши условно обозначены крестиками. Наряду с зародышеобразованием имеет место процесс разрушения зародышей. После того как некоторым молекулам удается занять нужные позиции, энергия их движения может быть настолько велика, что они столкнут друг друга с этих позиций и сделают невозможным зародышеобразование. Кроме того, уже образовавшиеся зародыши могут быть подвергнуты бомбардировке со стороны молекул из газовой фазы, разрушающей начавшуюся кристаллизацию.
В результате роста зародышей происходит их превращение в микроскопические кристаллы. По мере роста слоя криоосадка происходит «поглощение» мелких кристаллов более крупными, в результате чего средний размер кристаллов растет по мере увеличения толщины слоя криоосадка (рис. 1-10, б).
В последующей стадии образовавшиеся кристаллы при своем дальнейшем росте сталкиваются друг с другом, создают взаимные помехи в росте и, таким образом, образуют компактный криоосадок в виде поликристал-лического твердого тела с разупорядоченной структурой, состоящей из множества мелких беспорядочно ориентированных кристаллов, именуемых кристаллитами. Размеры кристаллитов, структура криоосадка и наличие всевозможных дефектов структуры зависят от многих параметров процесса конденсации: температуры газа и криопанели, интенсивности газового потока, рода конденсируемых газов, диапазона давлений в газовой фазе, флуктуации потоков, наличия неконденсируемых примесей и др. Эта стадия роста криоосадка изображена на рис. 1-10, в.

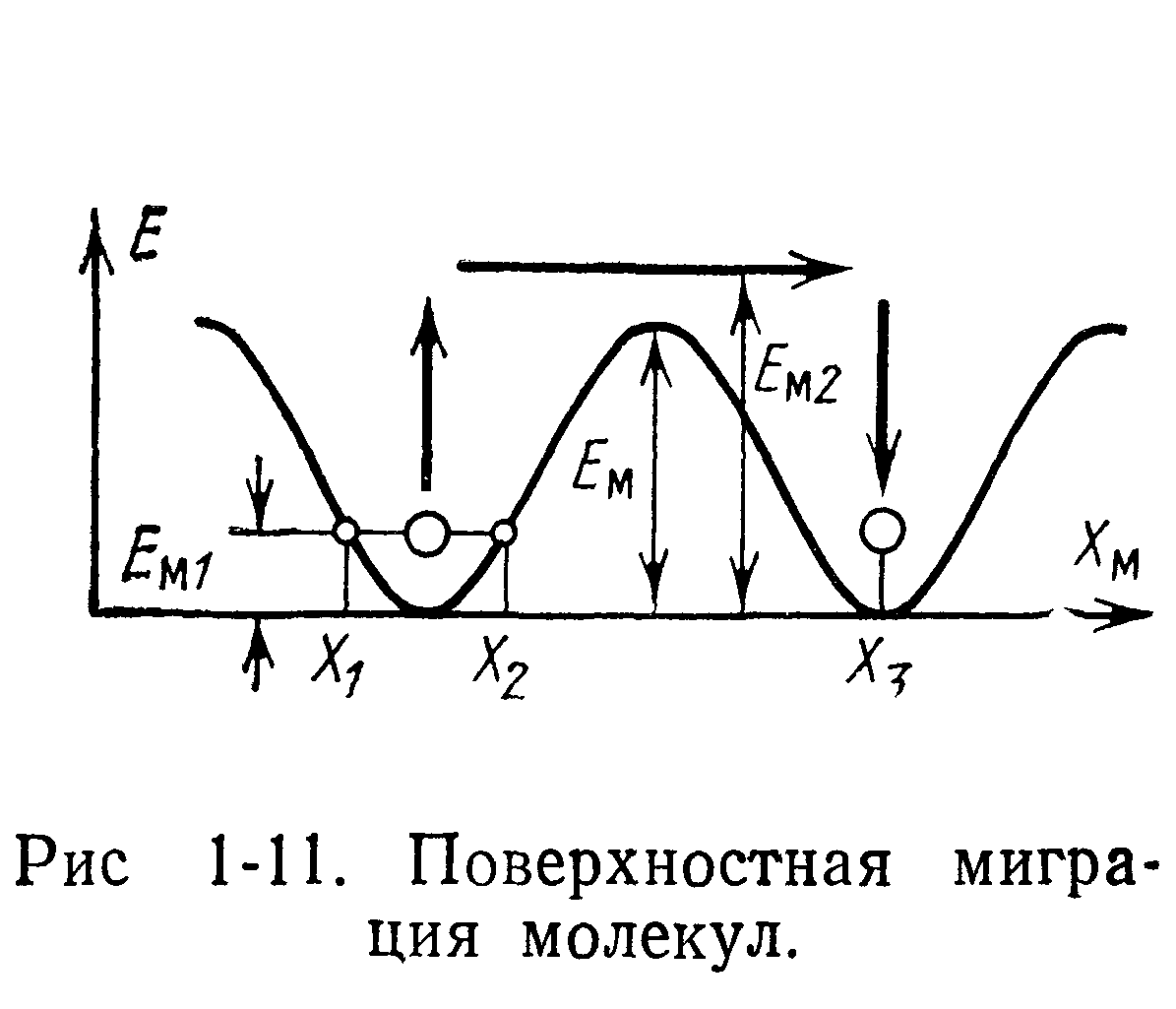
Большое значение для процесса роста криоосадка имеет явление поверхностной миграции частиц, падающих на поверхность кристалла Сущность этого явления может быть пояснена на двухмерной модели. Молекулы, находящиеся в углах кристаллической решетки, совершают колебательные движения не только в направлении, перпендикулярном поверхности криоосадка, но также имеют составляющую, расположенную в плоскости криоосадка. Периодическая структура решетки кристалла приводит к периодическому изменению потенциала взаимодействия частиц атомного ряда (периодичность потенциальных ям) в направлении, параллельном поверхности криоосадка, как это изображено на рис. 1-11. Энергетическое состояние £М1 молекулы, находящейся в потенциальной яме, вызывает поверхностные колебания молекулы в некоторых пределах Xi, Х2. Если молекула приобретает энергию Ем2 большую, чем Ем, то она может переместиться в положение х3.
Кинетика роста зародышей в виде куба с учетом взаимодействия ближайших соседних частиц иллюстрируется моделью Странского [1-10], представленной на рис. 1-12.
Молекулы, падающие на криоосадок из газовой фазы, оседают или отражаются от его поверхности. Частицы, остающиеся на поверхности, либо существовавшие на ней некоторое время, могут покинуть ее и вновь возвратиться в пространство; либо остаться непосредственно на месте встречи с Поверхностью; либо путем миграции они могут перемещаться по поверхности.
Согласно модели Странского поверхность кристалла во время роста обладает атомно-ступенчатой структурой. На ней различают конденсированные молекулы а, прочно связанные с решеткой кристалла, плоскоконден-сированные молекулы б, менее-прочно связанные с решеткой, но удерживаемые ею; плоскоадсорбированные в, которые после присоединения к ним молекулы могут перейти в плоскоконденсированные; линейно-адсорбированные г, имеющие возможность мигрировать вдоль ребра кристалла и превращаться в плоскоадсорбирован-ные; плоскоадсорбированные частицы д, слабо связанные с решеткой кристалла и могущие, побыв некоторое время в адсорбированном состоянии, покинуть поверхность криосадка. Плоскоадсорбированные частицы так-жем могут мигрировать по поверхности с очень малой затратой энергии и занимать более устойчивые положения, такие, как линейно-адсорбированные г или плоско-конденсированные в. Это и приводит к построению все новой и новой плоскости куба, т. е. к росту кристаллита.
Структурное строение криоосадка. В последние годы проведено большое количество работ по исследованию структур твердых газов с помощью дифракции рентгеновских лучей, электронов и нейтронов.
Газы при превращении в твердое состояние образуют молекулярные кристаллы. Этот класс кристаллов отличается тем, что в узлах их кристаллической решетки находятся устойчивые молекулы, которые сохраняют свою химическую индивидуальность не только в газообразной, но и в твердой фазе. Частицы удерживаются в узлах решетки ван-дер-ваальсовыми силами, которые в молекулярных кристаллах являются сравнительно слабыми. Они во много раз слабее сил, связывающих частицы в ионных, атомных или металлических кристаллах. Это и объясняет быструю разрушаемость молекулярных кристаллов при нагревании.
Наиболее простыми по структуре являются кристаллы инертных газов. Несмотря на то, что решетки образуются в этих кристаллах атомами инертного газа, однако по характеру связей их относят к молекулярным, а не к атомным. В этом случае «молекулы» одноатомны и связаны друг с другом только дисперсионными силами межмолекулярного сродства- Поэтому твердые инертные газы рассматриваются обычно как молекулярные, а не как атомные кристаллы.

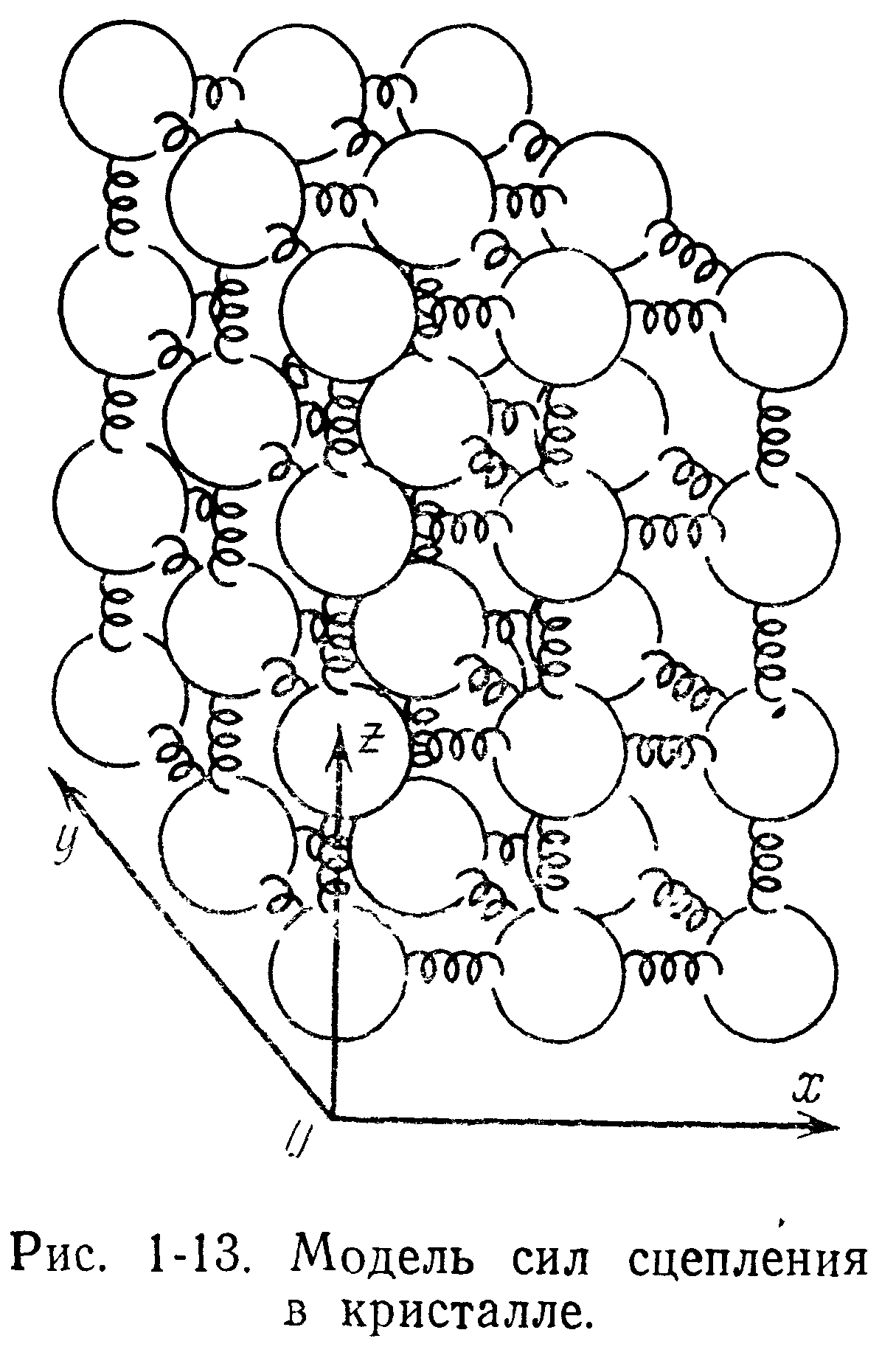
Частица, находящаяся в конденсированном состоянии, совершает небольшие колебания относительно некоторого положения равновесия по сравнению с теми, какие она совершала бы в газе или жидкости. Можно представить себе кристалл как правильную решетку из шаров (молекул или атомов), соединенных друг с другом пружинками, моделирующими силы, удерживающие частицы (рис. 1-13). Если в такой модели одну из частиц вывести из равновесного положения, а затем освободить, то она под действием пружинок будет колебаться. В реальном кристалле все частицы постоянно колеблются во всех направлениях относительно их состояний равновесия, и это движение определяет температуру твердого тела, так же как и в газе температура определяется свободным движением атомов.
При низкой температуре процесс конденсации сопровождается более интенсивным образованием центров кристаллизации за счет эффективного энергообмена между частицами газовой фазы и криоосадка и ограниченной поверхностной миграции конденсируемых частиц. Эти обстоятельства обусловливают рост мелкокристаллической («рыхлой») структуры криоосадка.
При сравнительно высоких температурах криопанели процесс конденсации сопровождается противоположными явлениями, что приводит к образованию относительно крупнокристаллической структуры криоосадка.
На структуру криоосадка оказывает влияние также и давление в объеме, при котором происходит конденсация газа в твердое состояние. При сравнительно низких давлениях складываются благоприятные условия для роста более крупных кристаллов; и наоборот, при более высоких давлениях происходит образование мелкокристаллической структуры.
Кристаллографические исследования показали, что многие газы в твердом состоянии могут иметь несколько модификаций с различными кристаллическими структурами. Инертные газы при кристаллизации образуют (кроме гелия) простые кубические гранецентрированные решетки. Вещества с двух- и многоатомными молекулами образуют более сложные по структуре кристаллы. Даже такие наиболее симметричные и сравнительно простые молекулы, как Н2, N2, О2, при относительно высоких температурах образующие гексагональную структуру, при низких температурах имеют кубическую стабильную структуру.
При быстрой конденсации на очень холодных поверхностях могут образовываться аморфные криоосадки. Это объясняется тем, что резкое понижение температуры сопровождается замедлением молекулярных движений, в результате чего уменьшается вероятность правильной взаимной ориентации молекул при конденсации. Образующееся при этом твердое тело будет не в кристаллическом, а в аморфном виде. Это происходит, например, при конденсации О2 при температуре ниже 7 К. Пары воды конденсируются в аморфную фазу уже при температуре ниже 123 К.
От структуры криоосадка во многом зависят его физические свойства, а также эффективность криоконден-сационной откачки.
Реальное структурное строение криоосадка не совпадает с представлением об идеальном кристалле. В практических случаях приходится откачивать сложный состав газов, при этом температура криопанели не во всех участках одинакова. Реальная структура сконденсированных на криопанели газов характеризуется большим количеством несовершенств — трещинами, дислокациями, включениями и др.
Однако, несмотря на то, что каждый из кристаллитов анизотропен и в его структуре множество несовершенств, благодаря хаотической ориентации кристаллитов и вероятностному распределению дефектов можно предположить, что криоосадок в целом изотропный и что его физические свойства одинаковы во всех направлениях.
Физические свойства криоосадка. Физические свойства криоосадка, как уже указывалось, являются весьма сложными для исследования, так как они существенно зависят от условий, при которых происходит конденсация газов в твердое состояние. Поэтому приведенные в этом разделе некоторые числовые значения следует рассматривать как ориентировочные и весьма приближенные.
Плотность конденсированных газов представляет собой массу единицы объема криоосадка и выражается в кг/м3 или г/см3.
В табл. 1-4 представлены значения плотности основных технических газов (паров) [1-3].
Таблица 1-4
Плотность газов в твердофазном состоянии
|
Газ (пар) |
Температура, К |
Плотность, г/см3 |
|
n2 |
’20-63 |
0,95 |
|
о2 |
20,6 |
1,43 |
|
н2 |
4,2—13 |
0,08 |
|
н2о |
77 |
0,58 |
|
со |
21—65 |
0,98 |
|
со2 |
77—194 |
1,53 |
|
сн4 |
20 |
0,52 |
|
Аг |
20—83 |
1,69 |
|
Ne |
4,3—24 |
1,44 |
|
Кг |
14—78 |
2,96 |
|
Хе |
130 |
3,64 |
Тепловая нагрузка на криопанель за счет теплового излучения во многом зависит от поглощательной способности криосадка, которая оценивается степенью черноты поверхности. Степень черноты представляет собой отношение энергии, излучаемой телом, имеющим температуру Т, к энергии излучения абсолютно черного тела при той же температуре. По закону Кирхгофа коэффициент лучепоглощения для любого тела численно равен соответствующему данной температуре значению степени черноты этого тела.
Численное значение величины степени черноты криоосадка существенно зависит от его состава, состояния, температуры и толщины слоя.
Эффективность процесса криооткачки также во многом зависит от того, как быстро может быть передана теплота конденсации через слой криоосадка, т. е. от его теплопроводности.
Теплота в криоосадке, как и во всех твердых телах, передается колебаниями кристаллической решетки. Если одна из частиц, находящаяся в узле решетки, получила тепловой импульс и стала колебаться с увеличенной амплитудой, то она, будучи связана с соседними частицами «упругими» связями, будет действовать на них, вызывая увеличение амплитуды колебания этих частиц. Так как различные слои криоосадка находятся на различных температурных уровнях, то через криоосадок возникает непрерывный поток теплоты.
В молекулярных кристаллах тепловые колебания, кроме поступательного колебательного движения молекул, обусловлены еще их крутильными колебаниями, а также колебаниями атомов внутри молекул.
По закону Фурье тепловой поток через криоосадок
где QT — тепловой поток, Дж/с; К — коэффициент теплопроводности, Вт/(см-К); t — толщина криоосадка, см; F — сечение теплопровода, см2.
В табл. 1-5 приведены приближенные значения коэффициента теплопроводности криоосадка некоторых газов.
Коэффициент теплопроводности газов в твердофазном состоянии
|
Вид газа |
Температура, К |
Коэффициент теплопроводности, Вт/(см-К) |
|
N2 |
60—62 |
ЫО-з |
|
н2 |
10—14 |
1-10-2 |
|
сн4 |
14—20 |
0,8-Ю-з |
|
Аг |
5—20 |
2,2-10-2 |
|
Кг |
5—40 |
1,8-10-2 |
|
Ne |
4—10 |
1,2-10-2 |

Газ конденсируется в твердую фазу тогда, когда его парциальное давление выше давления насыщенных паров при данной температуре криопанели.
Давление насыщенных паров Рн затвердевшего газа в функции абсолютной температуры выражается формулой


где А и В — коэффициенты, постоянные для данного газа.
Значения температур насыщенного пара наиболее важных для вакуумной техники веществ при низких давлениях приведены в табл. 1-6(1-11].
На рис. 1-14 представлена графическая зависимость давления насыщенных паров от температуры. Из представленных кривых видно, что, охлаждая криопанель до температуры жидкого азота (77 К), удается снизить содержание паров воды до незначительной величины. Однако при этой температуре не может быть получен высокий вакуум, если присутствуют такие газы, как метан, азот и кислород. Упругость паров этих газов можно довести до уровня менее 1-10~8 Па охлаждением криопанели до температуры жидкого водорода (20,4 К). При этой температуре не конденсируются только неон, водород, гелий. При 4 К неконденсированным остается только Не.


